Aspargi, Inbiomed y nanoGUNE trabajan juntos contra el Parkinson
Aspargi, la Asociación Parkinson Gipuzkoa (País Vasco), ha apoyado con una beca de 6.000€ un proyecto de investigación conjunta entre Inbiomed y nanoGUNE, que desarrolla mejores formas de generar neuronas para así poder investigar los mecanismos de la enfermedad y encontrar nuevos tratamientos.
En 2014, Aspargi decidió contribuir económicamente a la investigación de la Enfermedad de Parkinson (EP), con el objetivo de concienciar sobre la enfermedad y la necesidad de investigar las causas y los posibles tratamientos. Tras la celebración del Día Mundial del Parkinson en 2014, el 11 de abril, la asociación comenzó una campaña para recaudar fondos y puso en marcha una convocatoria abierta para la presentación de proyectos. Debido a que la idea era promover la colaboración, los proyectos debían estar planteados por al menos dos centros diferentes de Gipuzkoa.
En marzo de 2015, la asociación anunció que el ganador del premio de 6.000€ era el proyecto conjunto presentado por Inbiomed y nanoGUNE, liderado por la Dra. Rosario Sánchez Pernaute, de la Fundación Inbiomed, y la Dra. Amaia Rebollo, y el Dr. Alexander Bittner, Profesor Ikerbasque en nanoGUNE. Este proyecto de investigación conjunta busca desarrollar la mejor forma de generar neuronas para que puedan ser usadas tanto para investigar como para tratar la enfermedad.
El proyecto comenzó en 2012, cuando los investigadores empezaron a pensar en nuevas formas de implementar el crecimiento y el trasplante de neuronas derivadas de células madre empleando nanomateriales. “El objetivo de nuestra investigación es hacer crecer las células en un entorno similar al de nuestro cerebro. Habitualmente, las células son tratadas e incubadas en placas de Petri en laboratorios, pero el resultado no es perfecto”, explica Sánchez. “Creemos que esto puede deberse (al menos en parte) a que no están creciendo en su entorno propio, así que trabajamos para recrear unas condiciones más parecidas a las naturales” añade.
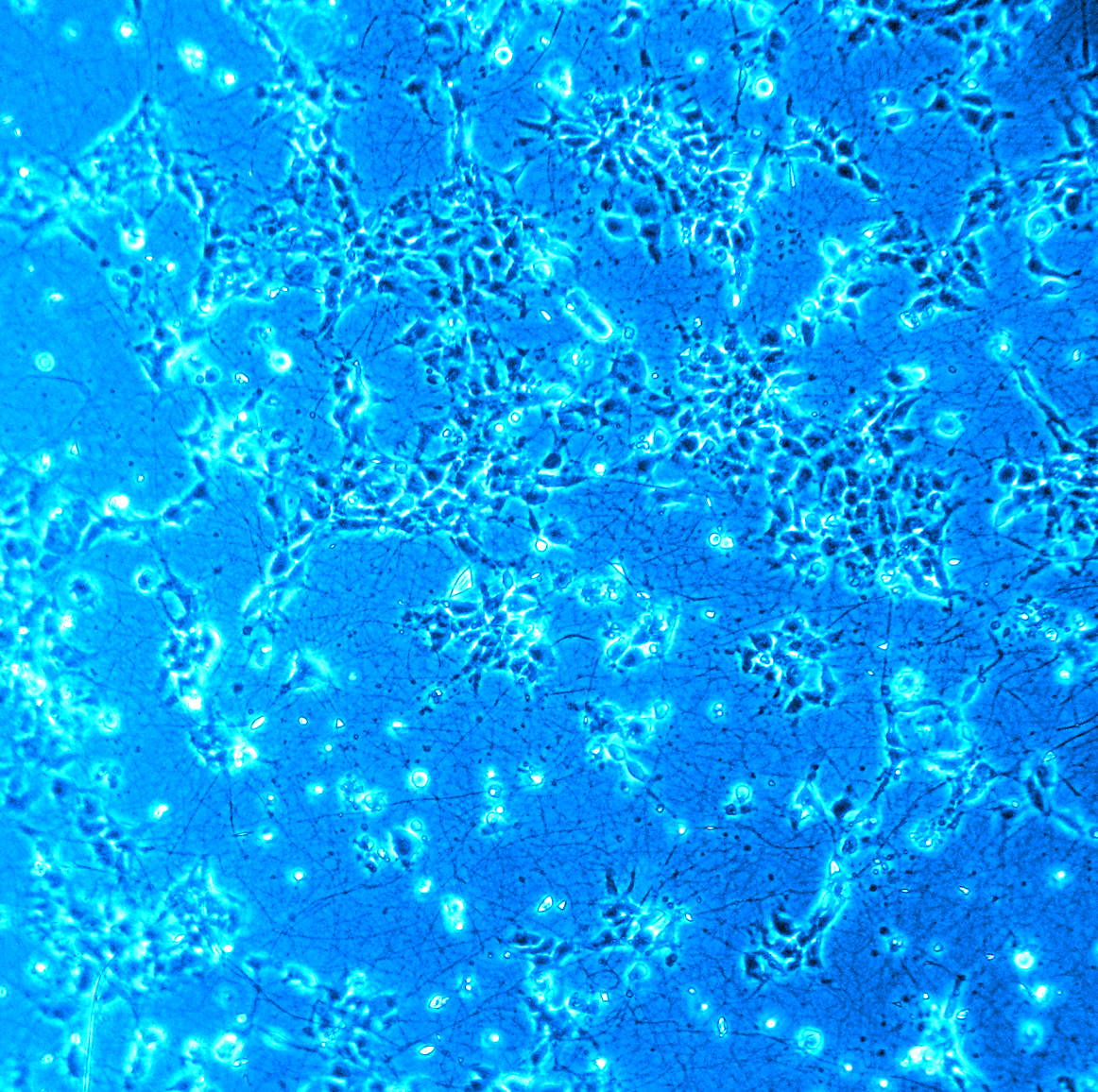
En nanoGUNE, los investigadores crean un “nanoespacio”, hecho de una matriz de fibras poliméricas, donde las células encuentran un buen lugar para instalarse. “Empleamos una técnica llamada electrohilado, que nos permite dibujar finísimas líneas de fibra a partir de una solución polimérica líquida. Modificamos el polímero con las proteínas adecuadas, creando así un entorno similar al ambiente natural en el que viven las neuronas en nuestro cerebro”, explica Alexander Bittner, líder del grupo de Autoensamblado de nanoGUNE. En Inbiomed, los investigadores se encargan de crecer las células dentro de la matriz de fibras para obtener neuronas que se comporten como neuronas normales. Esto permite investigar cómo crecen, funcionan y envejecen.
Hacia una terapia de sustitución para tratar el Parkinson
Rosario Sánchez explica que el Parkinson debería ser llamado síndrome en lugar de enfermedad, ya que es un conjunto de síntomas que pueden deberse a diferentes causas. “Aunque parece que hay diferentes causas para el Parkinson, tienen en común la pérdida de dopamina que ocurre cuando las neuronas encargadas de producirla degeneran y mueren. Los tratamientos actuales consisten en reemplazar la dopamina mediante diferentes vías (medicamentos, células o genes) para así mejorar los síntomas típicos del Parkinson: temblores, lentitud, dificultad para alternar movimientos, etc.”, añade Sánchez.
“Las nuevas ideas para tratar y prevenir las enfermedades no requieren necesariamente del empleo de medicamentos. En el caso de la EP es posible reemplazar las células dañadas por nuevas neuronas”, explica Bittner. “El problema es que, para esto, necesitamos células frescas; células madre en un estadio de desarrollo muy temprano, que nos permita programarlas para que se conviertan en las células que queremos”, añade Bittner. La “reprogramación” permite emplear células madre, obtenidos, por ejemplo, de la piel del paciente.
Las terapias de sustitución celular para tratar el Parkinson, aunque en fase experimental, están siendo empleadas en estos momentos. Esta terapia podría ser una alternativa al empleo de medicamentos basados en dopamina que presentan dos problemas principales: la pérdida de eficacia con el tiempo y la dificultad de determinar con exactitud la cantidad de dopamina que el paciente necesita. “Empleando células, la cantidad de dopamina se regularía internamente, ya que ellas (las neuronas productoras de dopamina) cuentan con sensores, los receptores (de dopamina) para ello”, explica Sánchez. “Aún así –añade– uno de los principales problemas de las terapias clásicas de sustitución es la de obtener la suficiente cantidad de células para el tratamiento, ya que estas células tienen que ser extraídas de un embrión en una fase de desarrollo muy temprana”. Esta es la razón por la que es tan importante dar con la forma de obtener buenas neuronas funcionales a partir de células madre (del paciente) para los tratamientos sustitutivos.
